Las leyes de la termodinámica: comprensión de la energía en movimiento.
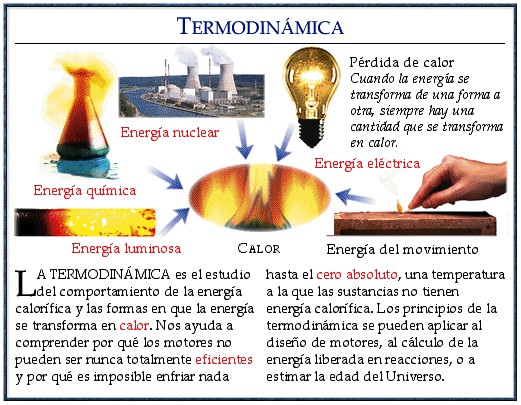
Introducción
La termodinámica es una rama de la física que estudia la energía y el calor en relación con el trabajo mecánico. En ella se encuentran las leyes que rigen el comportamiento de los sistemas termodinámicos. Entre estas leyes, las más importantes son la primera y la segunda ley de la termodinámica, que explican cómo la energía se mueve y se transforma en los sistemas.
Primera ley de la termodinámica
La primera ley de la termodinámica establece que la energía no se crea ni se destruye, sino que se transforma de una forma a otra. En otras palabras, la energía total de un sistema aislado se mantiene constante.
Esta ley se puede expresar mediante la ecuación:
Energía total = Energía interna + Energía cinética + Energía potencial
Donde la energía interna se refiere a la energía almacenada en las moléculas y átomos del sistema, y la energía cinética y potencial se refieren a la energía asociada con el movimiento y la posición de las partículas.
Es importante destacar que esta ley se aplica a sistemas cerrados, es decir, aquellos que no intercambian energía con el entorno.
Segunda ley de la termodinámica
La segunda ley de la termodinámica establece que la entropía de un sistema aislado nunca disminuye, sino que siempre aumenta o permanece constante.
La entropía es una medida de la cantidad de desorden o aleatoriedad en un sistema. Siempre tiende a aumentar porque los procesos naturales tienden a ser irreversibles, es decir, no se pueden deshacer y vuelven al estado inicial. Por ejemplo, el proceso de enfriamiento de un objeto caliente nunca se revierte por sí mismo, sino que sigue enfriándose hasta que alcanza la temperatura del entorno.
Esta ley se puede expresar mediante la ecuación:
ΔS ≥ 0
Donde ΔS es el cambio en la entropía del sistema. Si ΔS es mayor que cero, la entropía aumenta y si es igual a cero

Entradas relacionadas