La Primera Ley de la Termodinámica: La conservación de la energía en los sistemas termodinámicos
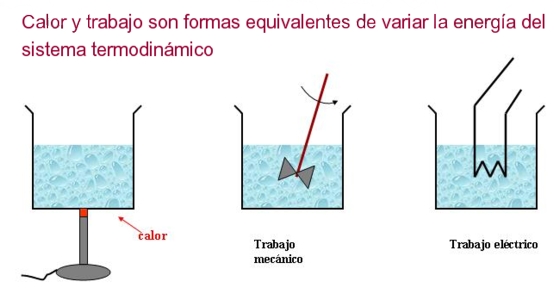
La Primera Ley de la Termodinámica es un principio fundamental en la física y la ingeniería que establece la conservación de la energía en los sistemas termodinámicos. Esta ley establece que la energía no puede crearse ni destruirse, sino que puede transformarse de una forma a otra.
¿Qué es la termodinámica?
Antes de entrar en detalle en la Primera Ley de la Termodinámica, es importante tener una comprensión básica de lo que es la termodinámica. La termodinámica es una rama de la física que se encarga del estudio de los procesos que involucran calor y trabajo. Se enfoca en cómo la energía se transforma en los sistemas y cómo los sistemas responden a estos cambios de energía.
La ecuación de la Primera Ley de la Termodinámica
La ecuación de la Primera Ley de la Termodinámica establece la relación entre la energía transferida a un sistema y el trabajo realizado por el sistema. La ecuación se expresa como:
ΔU = Q - W
Donde ΔU es el cambio en la energía interna del sistema, Q es la cantidad de calor transferida al sistema y W es el trabajo realizado por el sistema.
Explicación de la ecuación
La ecuación de la Primera Ley de la Termodinámica establece que el cambio en la energía interna de un sistema es igual a la cantidad de calor transferida al sistema menos el trabajo realizado por el sistema. Si el calor se transfiere al sistema y no se realiza ningún trabajo, la energía interna del sistema aumenta. Si el trabajo se realiza en el sistema y no se transfiere calor, la energía interna del sistema disminuye. Si la cantidad de calor transferida al sistema es igual al trabajo realizado por el sistema, la energía interna del sistema no cambia.
Ejemplo de aplicación de la Primera Ley de la Termodinámica
Un ejemplo común de la aplicación de la Primera Ley de
Deja una respuesta

Entradas relacionadas